MICROBIOLOGIA CLÍNICA PARA ANIMAIS SILVESTRES/SELVAGENS
A Microbiologia Veterinária é a área que estuda os microrganismos, como bactérias, fungos e vírus, com potencial patogênico para os animais e suas relações com o hospedeiro.
A Medicina Veterinária de Animais Silvestres/Selvagens vem se aperfeiçoando não só na área de pesquisa, mas também na rotina clínica, uma vez que atualmente é crescente o mercado pet destes animais, o que resultou em aumento de criadouros com fins comerciais e o domiciliamento como animais de estimação. Os animais silvestres também são encontrados cativos em zoológicos, criadouros conservacionistas ou científicos, institutos de pesquisa e centros de triagem e reabilitação.
Os animais mantidos em cativeiro estão em constante contato com microrganismo, distribuídos no ambiente, em sua microbiota e através da manipulação por seus tutores ou tratadores. Em situações específicas, como por exemplo, stress ou baixa da resistência, até mesmo bactérias que fazem parte de sua microbiota podem tornar-se patogênicas e desenvoverem doenças.
Na prática clínica, a microbiologia constitui-se em importante ferramenta diagnóstica de agentes infecciosos ou oportunistas, além de poder orientar terapias eficientes pela indicação de antibióticos específicos e fornecer informações para o estabelecimento de programa de prevenção e manejo ideal que possibilite o controle microbiológicos nas diferentes espécies.
Ainda, com o avanço da agricultura e pecuária próximo às áreas naturais, o contato entre a população humana e seus animais domésticos com animais silvestres tornou-se mais próximo e, com isso, facilitou-se a disseminação de agentes infecciosos e parasitários para novos hospedeiros e ambientes. Como consequência negativa dessa interação, doenças pouco conhecidas ou que não apresentavam mais importância epidemiológica apareceram em surtos ou epidemias em uma população e, dentre elas, enfermidades com potencial zoonótico, como o caso da Febre Amarela em São Paulo em 2018/2019.
Desta forma, o estudo epidemiológico de patógenos em populações selvagens no ambiente in situ e ex situ é essencial para o estabelecimento de programas de controle, prevenção e monitoramento de doenças que os acometem e subsidiar as ações em Saúde Pública Veterinária.
| EXAMES MICROBIOLÓGICOS | MATERIAL | RESULTADO |
| Coprocultura + Antibiograma | Fezes* ou "Swab" retal/cloacal*** | 5 a 7 dias |
| Cultura de pele / ouvido / olho (bactérias e leveduras) + Antibiograma | Swab*** e ou Raspado superficial de pele e pelos (mamíferos)** | 3 a 5 dias |
| Cultura com número de UFC + Antibiograma | Urina****, Sêmen | 3 a 5 dias |
| Cultura de bactérias aeróbias de sítios não cutâneos + Antibiograma | Secreções, Excreções ou Fagmentos de Órgãos | 3 a 5 dias |
| Cultura para Brucella sp | Sangue total em frasco para hemocultura, Urina****, Feto, Secreções ou Fragmentos de Órgãos | 7 a 15 dias |
| Cultura para dermatófitos e outros fungos micelianos e leveduriformes com importância médica | Raspado superficial de pele/pelos** | 7 a 30 dias |
| Cultura para fungos causadores de micoses profundas | Secreções, Excreções ou Fragmentos de Órgãos | 7 a 30 dias |
| Hemocultura | Sangue total em frasco para hemocultura***** | 7 a 30 dias |
| Cultura para Mycobacterium sp | Secreções, Excreções ou Fragmentos de Órgãos | 20 a 60 dias |
| Exame direto para pesquisa de artrósporos de dermatófitos (tricografia) | Raspado superficial de pele/pelos** | 24/48 h |
| Exame direto para pesquisa de bactérias e leveduras (método de Gram) | Secreções, Excreções ou "Imprint" de Órgãos (lâminas)****** | 24/48 h |
| Isolamento de anaeróbios (presença/ausência) | Sangue total em frasco para hemocultura*****, Secreções, Excreções ou Fragmentos de Órgãos | 5 a 7 dias |
*FEZES (coletor universal plástico)
- Colher amostras de fezes frescas, recém eliminadas em frasco limpo e refrigerá-las imediatamente.
- Amostras muito líquidas podem ser colhidas do piso com o auxílio de seringa. A amostra também pode ser colhida diretamente do reto.
- Quantidade: 10 a 20 g ou 10 a 20 ml.
**RASPADO SUPERFICIAL DE PELE E PELOS
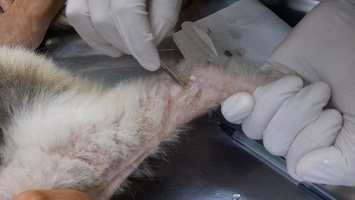 Fonte: http://fmvz.uas.edu.mx/CHPE5.html
Fonte: http://fmvz.uas.edu.mx/CHPE5.html
- Método para detecção de fungos.
- Caso o animal esteja em tratamento, aguardar 15 dias após suspender o antifúngico, antes de realizar a colheita.
- Caso esteja sendo aplicado medicamento tópico, como pomada ou creme, lavar o local e colher no dia seguinte.
- Higienizar a área da lasão com água e sabão neutro, cortar o excesso de pelos e fazer antissepsia com álcool 70%.
- Para a acolheita, utilizar lâmina de bisturi estéril.
- Com a lâmina de bisturi, realizar raaspado de escamas superficiais de pele.
- Os pelos devem ser colhidos na região das bordas da lesão com auxílio de pinça ou avulsão.
- Acondicionar em coletor estéril ou entre lâmnias de microscopia (vedar o vão entre as lâminas com esparadrapo ou envolver com filme de PVC)..
- Identificar a amostra.
- Manter à temperatura ambiente.
***SWAB COM MEIO DE TRANSPORTE
O "swab" se assemelha a um contonete, formado por uma haste de plástico ou madeira e revestido, em uma das pontas com algodão especial com alta capacidade de absorção.
Para garantir a mínima interferência na qualidade do material colhido durante a fase pré-analítica é utilizado para a colheita, armazenamento e transporte da amostra, swabs estéreis com meio de Stuart.
O meio encontra-se dentro de um tubo semi-preenchido no qual é inserido o swab qu está acoplado em tampa própria que veda o recipiente.
Esse material proporciona proteção contra possíveis contaminações, além de conservar os agentes microbianos durante o transporte.
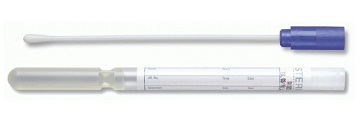
Fonte: https://www.casalab.com.br/produtos/67/3143_
SWAB ÓPTICO/CONJUNTIVAL
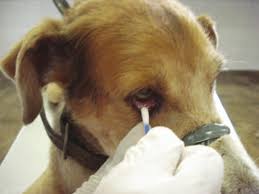
Fonte: AZEVEDO et al, 2009.
- Limpar as pálpebras com gaze umedecida em solução fisiológica para retirar secreções e sujidades oculares externas
- Inserir swab no saco conjuntival e realizar movimentos giratórios, cuidando para não entrar em contato com o tarso pálpebral e pálpebras.
- Colocar o swab no frasco contendo o meio de transporte.
- Identificar a amostra.
- Conservar sob refrigeração (2 a 8ºC).
SWAB ÓTICO
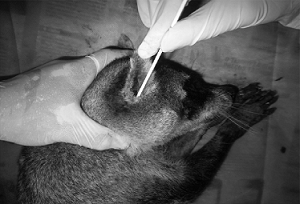 Fonte: LIMA et al, 2012.
Fonte: LIMA et al, 2012.
- Realizar rigorosa antissepsia da região externa do pavilhão auricular.
- Colher com o swab o material diretamente do conduto auditivo.
- Colocar o swab no frasco contendo o meio de transporte.
- Identificar a amostra.
- Conservar sob refrigeração (2 a 8ºC).
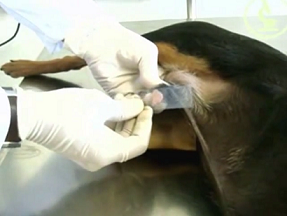
SWAB RETAL/CLOACAL
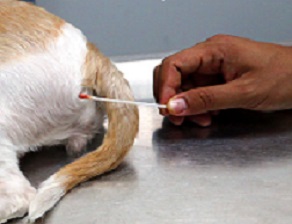 Fonte: http://www.asiahomes.com/angelfire/tpvets_Aug26_14.htm
Fonte: http://www.asiahomes.com/angelfire/tpvets_Aug26_14.htm
- Umedecer o swab em salina estéril (não usar gel lubrificante) e inserir 1 a 2 cm além do esfíncter anal, fazendo movimentos giratórios.
- Ao retirar, certifique-se que existe coloração fecal no algodão.
- Colocar o swab no frasco contendo o meio de transporte.
- Identificar a amostra.
- Conservar sob refrigeração (2 a 8ºC).

Swab Cloacal. Fonte: https://www.youtube.com/watch?v=A7aYyl9Yv9o
SWAB CUTÂNEO
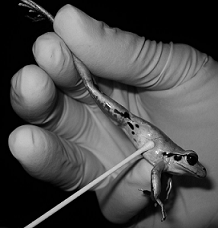 Fonte: https://www.researchgate.net/profile/Jean-Marc_Hero
Fonte: https://www.researchgate.net/profile/Jean-Marc_Hero
- Realizar tricotomia e rigorosa antissepsia da região.
- Em lesões superficiais colher com movimentos giratórios e vitar contato com a pele ao redor.
- Em fístulas e abscessos abertos, espremer o material da profundidade para colher com o swab.
- Colocar o swab no frasco contendo o meio de transporte.
- Identificar a amostra.
- Conservar sob refrigeração (2 a 8ºC).
****URINA (tubo cônico, coletor universal ou seringa)

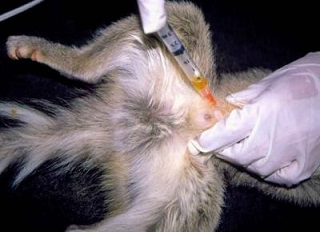
Fonte: http://www.saudecominteligencia.com.br/exame-de-urina-i.htm Fonte: https://bunzlsaude.com.br/ Cistocentese em Bassarisco (Bassariscus astutus). Fonte: https://noahspath.com
- Colher amostra de urina preferencialmente com sonda ou por cistocentese, ou ainda por micção espontânea após anti-sepsia de vulva/prepúcio e desprezando os primeiros jatos.
- Colocar no coletor ou deixar na seringa.
- Volume indicado: 10ml. Excepcionalmente são aceitos volumes inferiores.
- Identificar a amostra.
- Refrigerar imediatamente (2- 8ºC).
*****SANGUE TOTAL EM FRASCO PARA HEMOCULTURA

- Realizar tricotomia e rigorosa antissepsia com álcool iodado da região a ser puncionada.
- Atenção para não palpar novamente a pele sobre a veia a ser puncionada.
- Colher por punção venosa de 2 a 5 ml de sangue.
- Desinfetar a tampa do frasco de hemocultura com álcool 70 ou álcool iodado.
- Inocular o sangue no frasco.
- Homogeneizar a amostra com o meio de cultura.
- Identificar a amostra.
- Manter à temperatura ambiente.
> Solicitar a entrega do frasco com antecedência.
******IMPRINT DE ÓRGÃOS (DECALQUE, IMPRESSÃO OU "CLAPS")
Denomina-se decalque, impressão ou "claps" o procedimento no qual se coloca a a área do tecido em contato com a superfície da lâmina de vidro, de modo semelhante ao utilizado para se obter uma impressão digital.
Neste método, as células superficiais da lesão são transferidas para a superfície da lâmina.
É utilizado normalmente a prtir de fragmentos obtidos durante necropsias, biópsias ou diretamente em lesões cutâneas.
MÉTODO:
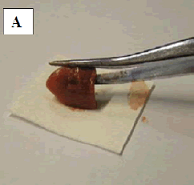
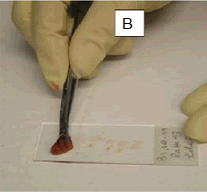

Referência: AYELE et al, 2017. Referência: https://acervovet.blogspot.com/2015/11/citologia.html
- Para fragmentos de tecido: obter fragmentos com 1 a 2 cm2; secar levemente em papel de filtro (A); pressionar levemente sobre a lâmina em vários locais ao longo de seu comprimento (B, C).
- Para lesões cutâneas: a lâmina é pressionada diretamente contra a área da lesão (figura à direita).
- Secar o material ao ambiente.
REFERÊNCIAS
ALVES, J.N.; ELSTON, L.B.; BRISOLA, M.L. Incidência de Candida spp segundo a sazonalidade em excretas de aves silvestres cativas analisadas no Laboratório ADN/Poços de Caldas - MG, Brasil (2010-2014). Pesquisa Veterinária Brasileira, v.37, n.10, p.1153-1158, 2017.
CALDAS, Cirlene da Cunha. Frequência de Cryptococcus spp e outras leveduras com potencial patogênico em excretas de aves silvestres em três municípios do estado de São Paulo. 2017. Dissertação (Mestrado em Saúde Pública) - Faculdade de Saúde Pública, Universidade de São Paulo, São Paulo, 2017.
CORRÊA, S.H.R.; PASSOS, E.C. Wild animals and public health. In: FOWLER, M.E.; CUBAS, Z.S. Biology, Medicine, and Surgery of South American Wild Animals. Ames: Iowa University Press, p. 493-499, 2001.
CUNHA, M. P.; GUIMARÃES, M.; DAVIES, Y.; MILANELO, L.; KNÖBL, T. Bactérias gram-negativas em cardeais (Paroaria coronata e Paroaria dominicana) apreendidos do tráfico de animais silvestres. Brazilian Journal of Veterinary REsearch and Animal Science, v.53, n.1, p.107-111, 2016. https://doi.org/10.11606/issn.1678-4456.v53i1p107-11
SILVA, Gilvandro da. Estudo dos parâmetros clínicos oftalmológicos, citológico e microbiológico em aves silvestres cativas na Região Metropolitana de Belém-Pa. Orientador: Washington Luiz Assunção Pereira. 2019. 59 f. Trabalho de Conclusão de Curso (Graduação em Medicina Veterinária) – Universidade Federal Rural da Amazônia, Campus Belém, PA, 2019.
GOMES, C.M.B.; BATISTA, K.S.; OLIVEIRA, S.A.; BEZERRA, L.M. Determinação de enterobactérias de mamíferos silvestres em criadouro conservacionista. Revista de Biologia e Ciências da Terra, v.11, n.2, 2011. Disponível em: < https://www.redalyc.org/pdf/500/50021611010.pdf >. Acesso em: 27 Set. 2019.
LIMA, Débora Costa Viegas de et al . Microbiologia de swabs retais e otológicos em carnívoros silvestres do zoológico do Parque Estadual de Dois Irmãos, Pernambuco. Pesq. Vet. Bras., v. 32, n. 2, p. 159-164, Feb. 2012 . Disponível em:< http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-736X2012000200012&lng=en&nrm=iso >. Acesso em: 27 Set. 2019. http://dx.doi.org/10.1590/S0100-736X2012000200012.
MURER, L. et al . Investigação de Salmonella spp. em Psittaciformes exóticos e nativos mantidos em cativeiro na região central do Rio Grande do Sul. Arq. Bras. Med. Vet. Zootec., Belo Horizonte , v. 70, n. 3, p. 815-822, June 2018 . Disponível em: < http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0102-09352018000300815&lng=en&nrm=iso >. Acesso em: 27 Set. 2019. 2019. http://dx.doi.org/10.1590/1678-4162-9794.
RODRIGUES, C.F.M.; RODRIGUES, V.S.; NERES, J.C.I.; GUIMARÃES, A.P.M.; NERES, L.L.F.G.; CARVALHO, A.V. Desafios da saúde pública no Brasil: relação entre zoonoses e saneamento. Scire Salutis, v.7, n.1, 2017. Disponível em: < http://www.sustenere.co/index.php/sciresalutis/article/view/SPC2236-9600.2017.001.0003 >. Acesso em: 27 Set. 2019.
SANTOS, Caroline Lunkes dos. Microbiota de psitaciformes silvestres e exóticos mantidos em centros de reabilitação e triagem. 2017. 66f. Dissertação (Mestrado em Ciências) - Programa de Pós-Graduação em Veterinária, Faculdade de Veterinária, Universidade Federal de Pelotas, Pelotas, 2017. http://guaiaca.ufpel.edu.br:8080/handle/prefix/4631
SILVA, Jean Carlos Ramos. Zoonoses e doenças emergentes transmitidas por animais silvestres. Portal Educação. Disponível em: < https://www.portaleducacao.com.br/conteudo/artigos/veterinaria/zoonoses-e-doencasemergentes-transmitidas-por-animais-silvestres/2463 >. Acesso em: 27 Set. 2019.
© LAB&VET | Todos os direitos reservados